《化学》电子教案
 
课题 | 第一章 化学基本概念和理论 第一节 走进微观世界——原子结构和化学键(之二) |
教学目标 | 1. 理解化学键、离子键的概念,掌握离子键的形成条件 2. 理解共价键的概念,掌握共价键的形成条件 3. 了解离子化合物和共价化合物的特点 |
教学重点 | 离子键和共价键概念的准确理解及其形成过程 |
教学难点 | 离子键和共价键的形成过程 |
课时安排 | 1学时 |
教学方法 | 启发式教学与讲练结合法 |
教学手段 | 多媒体辅助 |
教学用具 | 投影仪 |
 
【教学进程】
引入
物质通常是由分子、原子、离子构成的。原子可以结合成分子,也可以失去电子或得到电子形成带负电荷的离子。为什么原子能结合成分子?原子是怎样结合成分子的呢?原子又是怎样形成阴离子和阳离子,阴、阳离子又是怎样构成物质的呢?稀有气体元素的原子为什么不能结合呢?今天我们就来解释这些问题。
新课
第一章 化学基本概念和理论
第一节 走进微观世界——原子结构和化学键
板书
四、化学键
讲述
化学上把紧密相邻的两个或多个原子(或离子)之间强烈的相互作用,叫化学键。
板书
1.定义:紧密相邻的两个或多个原子(或离子)之间强烈的相互作用,叫化学键。
讲解
由于不同的物质是由不同的微观粒子构成,微观粒子之间作用的方式和强度也不同,化学键可根据不同微观粒子之间作用的方式和强度的不同,分为三种主要类型:离子键、共价键、金属键。
板书
2.主要类型:离子键、共价键、金属键。
板书
(一)离子键
设问
与人类生活密切相关的食盐化学成分是NaCl,是钠离子和氯离子组成的。通过钠在氯气中燃烧生成氯化钠这个实验,证实它们之间发生了化学反应,那么,Na+和Cl-是怎么结合的呢?
投影、练习
1. 请同学们写出Na和Cl原子的结构示意图。
2. 分组讨论:
(1)两种原子要达到稳定结构时,它们分别容易发生什么变化?
(2)当它们变化后又会发生什么相互影响呢?
和学生一起归纳:根据钠与氯原子的原子结构可知,钠原子最外层只有1个电子,在化学反应中易于失电子,氯原子最外层有7个电子,易于得电子;当它们反应时,钠原子最外层的1个电子会转移到氯原子最外层上去,分别形成带正电荷的Na+和带负电荷的Cl-,使各自电子层结构处于一个相对的“稳定结构”;而Na+和Cl-之间通过静电作用形成了NaCl。
副板书
用原子结构示意图表示NaCl的形成过程:
 
 
 
 
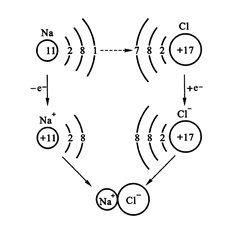
 
 
 
 
 
 
板书
离子键
(1)定义:通过阴、阳离子之间强烈的静电作用形成的化学键叫做离子键。
设问
为什么用带相反电荷的离子的相互作用,而不说是相互吸引呢?
和学生一起归纳:带相反电荷的离子相互吸引到一定距离时,由于电子层和电子层、原子核和原子核是相互排斥的,当吸引和排斥达到平衡时,带相反电荷的离子形成了稳定的离子键(或者说形成了稳定的化合物)。
讲解
通常活泼金属(如钾、钠、钙等)与活泼非金属(如氯、溴、氧等)都能形成离子键。
板书
(2)特点:由活泼金属与活泼非金属形成。
讲解
由离子键结合而成的化合物叫做离子化合物,如NaCl、KCl、MgO、CaO、ZnSO4、NaOH等还有绝大多数盐类、碱类、部分金属氧化物都是离子化合物。离子化合物的熔点、沸点较高,质硬而脆。
板书
2.离子化合物
(1)定义:由离子键构成的化合物叫做离子化合物。
(2)特点:熔点、沸点较高,质硬而脆。
引入
活泼金属的元素与活泼的非金属元素化合时形成离子键,那么非金属元素之间化合时,形成的化学键与离子键相同吗?
讲解
以氢分子、氯化氢分子的形成为例,分析化学键的形成过程。引导学生与离子键的形成过程进行对比导出共价键的概念。
由于氢原子仅有一个电子,要满足稀有气体原子的电子层结构,只能两个氢原子各自拿出1个电子,组成共用电子对,这个电子对既能使双方都达到“稳定结构”(氦原子的电子结构),又受两个原子核的共同吸引,使整个氢分子处于相对稳定的状态。HCl中的氢原子的一个电子,和Cl原子最外层的7个电子中的一个电子共用一对电子,彼此都能成为稳定结构,从而结合成为HCl分子。
板书
(二)共价键
1.共价键
(1)定义:原子间通过共用电子对所形成的化学键叫共价键。
指出
在化学上,常用一根短线表示一对共用电子对,因此,氢分子可表示为 H-H;HCl分子可表示为H-Cl。
讲解
通常,非金属元素的多原子单质分子和不同非金属元素相互结合而成的化合物分子都是靠共价键结合的。例如,Cl2、N2、H2O、NH3、CO2分子。只由共价键结合而成的化合物称为共价化合物,如HCl、NH3、H2O、酒精、甘油等。
板书
(2)特点:由非金属元素相互结合而成。
讲解
只由共价键结合而成的化合物称为共价化合物,如HCl、NH3、H2O、酒精、甘油等。共价化合物一般硬度小,熔点、沸点较低。
板书
2.共价化合物
(1)定义:只由共价键结合而成的化合物称为共价化合物。
(2)特点:硬度小,熔点、沸点较低。
小结
1.离子键和离子化合物的概念。
2.共价键和共价化合物的概念。
3.离子键与共价键形成的特点。
作业
思考与练习:5、6。
 
【板书设计】
第一章 化学基本概念和理论
第一节 走进微观世界——原子结构和化学键
四、化学键
1.定义:紧密相邻的两个或多个原子(或离子)之间强烈的相互作用,叫化学键。
2.主要类型:离子键、共价键、金属键。
(一)离子键
1.离子键
(1)定义:通过阴、阳离子之间强烈的静电作用形成的化学键叫做离子键。
(2)特点:由活泼金属与活泼非金属形成。
2.离子化合物
(1)定义:由离子键构成的化合物叫做离子化合物
(2)特点:熔点、沸点较高,质硬而脆。
(二)共价键
1.共价键
(1)定义:原子间通过共用电子对所形成的化学键叫共价键。
(2)特点:由非金属元素相互结合而成。
2.共价化合物
(1)定义:只由共价键结合而成的化合物称为共价化合物。
(2)特点:硬度小,熔点、沸点较低。
17
 

 负责人:黄剑鹏
负责人:黄剑鹏