《化学》电子教案
 
课题 | 第一章 化学基本概念和理论 第三节 物质变化的速率和进度——化学反应速率和化学平衡 |
教学目标 | 1.了解化学反应速率及其表示法 2.了解温度、浓度、压力和催化剂对化学反应速率的影响 3.了解吸热反应和放热反应、可逆反应和化学平衡 4.了解影响化学平衡移动的因素 |
教学重点 | 温度、浓度、压力和催化剂对化学反应速率的影响;影响化学平衡移动的因素 |
教学难点 | 影响化学平衡移动的因素 |
课时安排 | 2学时 |
教学方法 | 启发式教学法、演示法 |
教学手段 | 多媒体辅助、演示实验 |
教学用具 | 投影仪、相应实验药品及器材 |
 
【教学进程】
第三节 物质变化的速率和进度——化学反应速率和化学平衡
引入
在日常生活中,很多反应发生得有快有慢,如燃放烟花爆竹、照相底片感光在瞬间完成;石油和煤炭的形成需要非常缓慢的过程。这说明不同的化学反应具有不同的反应速率。我们希望食品、药品的保质期延长,金属锈蚀、塑料老化变得缓慢,又希望合成的一些化工产品能加速完成,转化的程度提高,这些都需要了解化学反应的速率和进程的知识。
新课
板书
一、化学反应速率及影响因素
讲解
在一定条件下,衡量化学反应进行快慢程度的物理量,称做化学反应速率,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。浓度的单位常用mol/L,化学反应速率的单位常用mol/(L·min)或mol/(L·s)。
板书
1. 概念:在一定条件下,衡量化学反应进行快慢程度的物理量,称做化学反应速率。
2.单位:用单位时间内反应物浓度的减少或生成物浓度的增加表示。
举例说明
某化学反应的某一反应物的最初浓度为2 mol/L,经过10 min后,它的浓度变成了1.8 mol/L,这就是说,该反应物的浓度减少了0.2 mol/L,则此化学反应的平均速率为0.02 mol/(L·min)。
讲解
化学反应速率的大小首先决定于反应物的本性。例如,在室温下金属钾和水能剧烈反应,而金属铁和水的反应就相当缓慢。此外,化学反应速率还与反应物的浓度、温度和催化剂等外界条件有关。
板书
3.影响因素:反应物的本性、反应物的浓度、温度和催化剂等。
(1)浓度的影响
演示实验
取a、b两支试管,在a试管中加入0.1 mol/L Na2S2O3(硫代硫酸钠)溶液4 mL,在b试管中加入0.1 mol/L Na2S2O3溶液2 mL及H2O 2 mL。另取2支试管分别注入0.1 mol/L H2SO4溶液4 mL,然后分别将H2SO4溶液同时倾入上面盛有Na2S2O3的2支试管中,振荡试管。
现象
浓度较大的a试管首先析出硫而变浑浊。
![]()
Na2S2O3 + H2SO4 Na2SO4 + S↓+ SO2↑+ H2O
总结并板书
当其他条件不变时,增加反应物的浓度,可以加快反应速率。
强调
对于有气体参加的反应,在一定条件下,压强增大,气体体积缩小,从而单位体积内分子数目增多,可以视为浓度增大,化学反应速率加快。
演示实验
取a、b两支试管,分别加入0.05 mol/L Na2S2O3溶液4 mL,另取2支试管,分别注入0.1 mol/L H2SO4溶液4 mL,然后将1支盛有Na2S2O3溶液的试管和1支盛有H2SO4溶液的试管组成一组,即4支试管组成两组。将第一组的试管插入冷水中,另一组试管插入60 ℃左右的热水中,2 min后同时分别将两组试管里的溶液混合。
现象
插在热水中的两种溶液混合后首先变浑浊。
讲解
温度对反应速率有显著的影响,且影响比较复杂。多数化学反应随温度升高,化学反应速率增大。一般温度每升高10 K,反应速率约增大2~4倍。
板书
(2)温度的影响
当其他条件不变时,升高温度可以增大反应速率;降低温度,可以减小反应速率。
(3)催化剂的影响
演示实验
取1支试管,加入5 mL 1% H2O2(过氧化氢)溶液,观察。然后,取玻璃棒1支,用水润湿一端,蘸取少量的MnO2粉末伸入试管中,再观察。
现象
H2O2溶液遇到MnO2后反应剧烈进行,有大量的气体产生;用带有火星的木条试验,可知产生的气体是氧气。
MnO2
![]()
2H2O2 2H2O + O2↑
 
讲解
多数催化剂是能加快化学反应速率的,但催化剂的催化作用是有选择性的,如合成氨工业中,采用铁触媒,加快了氨的合成速率。某种催化剂只能对某些特定的反应有催化作用,而对其他反应则不起作用。生物体内进行的各种生物化学反应,都是在酶的作用下进行的。如淀粉酶能促进淀粉水解,蛋白酶能促进蛋白质水解,脂肪酶能促进分解油脂。酵母片是一种多酶片,消化不良时食用酵母片,可以帮助人们消化食物,解除病痛。
板书
多数催化剂能加快化学反应速率。
过渡
物质的化学反应有快有慢,有些反应物转化的程度也很低,有些甚至在一定情况下会逆向进行。下面我们来学习化学平衡及影响因素。
板书
二、化学平衡及影响因素
(一)可逆反应与不可逆反应
讲解
有一些化学反应一旦发生就能不断进行,反应物几乎全部转变成生成物,我们认为这些只能向一个方向单向进行的反应是不可逆反应。
举例说明
氯酸钾的分解、火药爆炸、金属锈蚀、岩石风化、石油形成、橡胶老化、人类衰老,这些都是不可逆反应。
板书
1.不可逆反应:只能向一个方向单向进行的反应。
讲解
大多数化学反应都具有或多或少的可逆性。在同一条件下,反应物能转变成生成物,同时生成物也可以转变成反应物,这些能同时向两个相反方向进行的化学反应是可逆反应。
板书
2.可逆反应:能同时向两个相反方向进行的化学反应。
讲解
![]()
![]()
化学方程式中常用“ ”可逆符号代替“ ”。
举例说明
氮气和氢气化合生成氨气的反应就是可逆反应。
板书
![]()
N2+3H2 2NH3
指出
从左向右的反应为正反应,从右向左的反应称逆反应。
讲解
对于合成氨反应,反应开始时,由于反应物N2、H2浓度大,正反应速率较大;但当生成物NH3生成后,就产生了逆反应。开始时逆反应速率最小,随着反应的进行,N2、H2正反应的速率也随之减小,NH3浓度逐渐增大,逆反应速率也随之增大。当反应进行到一定程度时,正反应速率必然和逆反应速率相等。这时,只要外界条件不变,N2、H2浓度和NH3浓度达到不再随时间改变的状态,这时反应所处的状态,称为化学平衡状态,简称化学平衡。
板书
(二)化学平衡
1.概念:对于一可逆反应,当反应进行到一定程度时,正反应速率必然和逆反应速率相等。外界条件不变,反应物浓度和生成物浓度达到不再随时间而改变的状态,这时反应所处的状态。
讲解
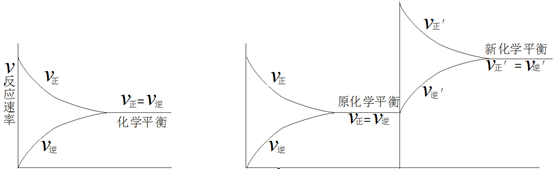
在一定条件下,密闭体系中进行的可逆反应,才能建立化学平衡,化学反应的正、逆反应速率相等(v正=v逆),各成分的浓度不再随时间改变,但是此时的化学平衡是动态平衡,当外界条件改变时,原平衡被破坏,可逆反应将在新条件下,建立新的化学平衡,这个过程称做化学平衡的移动。
板书
2.特点:等、定、动、变。
投影
化学平衡和化学平衡移动示意图
化学平衡示意图 化学平衡移动示意图
 
过渡
化学平衡是在一定条件下建立的,是一种相对的、动态的、暂时的平衡状态,一旦外界条件如浓度、压强、温度等改变,化学平衡状态也会改变。
板书
(三)影响化学平衡的因素
1.浓度的影响
讲解
在一定的化学平衡体系中,当其他条件不变时,若增加反应物(或减少生成物)浓度,平衡向正反应方向移动;若增加生成物(或减少反应物)浓度,平衡向逆反应方向移动。
演示实验
在三氯化铁和硫氰酸钾的反应平衡中,加入FeCl3或KSCN后,溶液的红色变深;加入KCl后,溶液的红色变浅。
![]()
FeCl3+6KSCN K3[Fe(SCN)6]+3KCl
血红色
现象及结论
增大生成物K3[Fe(SCN)6]的浓度,反应向逆反应方向进行;减小生成物K3[Fe(SCN)6]的浓度,反应向正反应方向进行。
板书
增大生成物的浓度,反应向逆反应方向进行;减小生成物的浓度,反应向正反应方向进行。
讲解
化学反应往往都伴随着能量的变化,这种能量的变化,主要表现为热能的形式,即有吸热或放热现象发生。凡能放出热量的反应称放热反应;凡能吸收热量的反应称吸热反应。
板书
2.温度的影响
(1)放热反应:能放出热量的反应。
(2)吸热反应:能吸收热量的反应。
举例说明
![]()
2HI H2(g)+ I2 -Q(-Q表示吸热)
![]()
2NO2(红棕色) N2O4(无色) +Q(+Q表示放热)
讲解
在放热或吸热的可逆反应里,反应混合物达到平衡状态以后,改变温度也会使化学平衡移动。
演示实验
把NO2和N2O4的混合气体分三份,放在三个烧瓶中,将其中两个连通,另一个作对比用。一个烧瓶放在热水中,另一个烧瓶放在冰水中,观察实验。
现象及结论
放在热水中的混合气体受热变深,说明NO2(红综色)浓度增大,即平衡向逆反应方向移动。放在冰水中的混合气体颜色遇冷时变浅,说明N2O4(无色)浓度增大,平衡向正反应方向移动。
板书
在其他条件不变时,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
讲解
在可逆反应达到平衡时,改变压强对反应前后气体总体积(或气体分子总数)不等的化学平衡有影响。
举例说明
![]()
N2(g)+3H2(g) 2NH3(g)
板书
3.压强的影响
讲解并板书
当其他条件不变时,增大压强,平衡向气体体积缩小(或分子总数减少)的正反应方向移动;减小压强,平衡向气体体积增大(或分子总数增加)的逆反应方向移动。
强调
对于反应前后气体总体积(或气体分子总数)不变的可逆反应,压强对化学平衡没有影响。
在化学平衡时,催化剂对正、逆反应速率影响相同,不能使化学平衡发生移动。
讲解
浓度、压强、温度对化学平衡的影响可以概括为平衡移动原理,也叫勒夏特列原理:如果改变平衡的一个条件(如浓度、压强或温度等,)平衡就向能够减弱这种改变的方向移动。
板书
平衡移动原理:如果改变平衡的一个条件,平衡就向能够减弱这种改变的方向移动。
小结
1.化学反应速率的概念和影响化学反应速率的因素。
2.化学平衡的概念和特点。
3. 影响化学平衡的因素。
4.平衡移动原理。
作业
综合练习:7、8。
 
【板书设计】
第三节 物质变化的速率和进度——化学反应速率和化学平衡
一、化学反应速率及影响因素
1. 概念:在一定条件下,衡量化学反应进行快慢程度的物理量,称做化学反应速率。
2.单位:用单位时间内反应物浓度的减少或生成物浓度的增加表示。
3.影响因素:反应物的本性、反应物的浓度、温度和催化剂等。
(1)浓度的影响
当其他条件不变时,增加反应物的浓度,可以加快反应速率。
(2)温度的影响
当其他条件不变时,升高温度可以增大反应速率;降低温度,可以减小反应速率。
(3)催化剂的影响
板书:多数催化剂能加快化学反应速率。
二、化学平衡及影响因素
(一)可逆反应与不可逆反应
1.不可逆反应:只能向一个方向单向进行的反应。
2.可逆反应:能同时向两个相反方向进行的化学反应。
![]()
N2 +3H2 2NH3
从左向右的反应称为正反应,从右向左的反应称为逆反应。
(二)化学平衡
1.概念:对于一可逆反应,当反应进行到一定程度时,正反应速率必然和逆反应速率相等。外界条件不变,反应物浓度和生成物浓度达到不再随时间改变的状态,这时反应所处的状态。
2.特点:等、定、动、变。
(三)影响化学平衡的因素
1.浓度的影响
增大生成物的浓度,反应向正反应方向进行;减小生成物的浓度,反应向逆反应方向进行。
2.温度的影响
(1)放热反应:能放出热量的反应。
(2)吸热反应:能吸收热量的反应。
在其他条件不变时,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
3.压强的影响
当其他条件不变时,增大压强,平衡向气体体积缩小(或分子总数减少)的正反应方向移动;减小压强,平衡向气体体积增大(或分子总数增加)的逆反应方向移动。
平衡移动原理:如果改变平衡的一个条件,平衡就向能够减弱这种改变的方向移动。
42
 

 负责人:黄剑鹏
负责人:黄剑鹏