《化学》电子教案
 
课题 | 第二章 溶液 第一节 解离平衡 第二节 水的离子积和溶液的pH |
教学目标 | 1.了解电解质的解离过程,明确强电解质、弱电解质的概念和区别 2.了解弱电解质的解离平衡 3.掌握水的离子积概念和表达 4.会用pH表示溶液酸碱度的方法 |
教学重点 | 弱电解质的解离平衡和水的离子积,pH表示溶液酸碱度的方法 |
教学难点 | 弱电解质的解离平衡和水的离子积概念 |
课时安排 | 2学时 |
教学方法 | 启发式教学与讲练结合法 |
教学手段 | 多媒体辅助 |
教学用具 | 投影仪 |
 
【教学进程】
引入
在日常生活中,作为调味用的醋,腌蛋用的盐水,供人饮用的茶水、汽水、多种清凉饮料和各种酒等都是溶液。在农业上,许多农药和化肥都需要配成溶液后使用。对于生命过程来说,溶液更是起着举足轻重的作用,动物摄取食物里的养料,植物吸取土壤里的肥分,氧气通过血液在身体里的循环等动植物的生理活动,都离不开溶液。本章我们就来学习有关溶液的知识。
板书
第二章 溶液
第一节 解离平衡
一、强电解质和弱电解质
设问
什么叫做电解质?
讲解
在水溶液中或熔融状态下能导电的化合物称为电解质;在水溶液中或熔融状态下不能导电的化合物称为非电解质。酸、碱、盐在水溶液中或熔融状态下能导电,属于电解质,蔗糖、酒精等属于非电解质。
板书
1.电解质:在水溶液中或熔融状态下能导电的化合物。
设问
酸、碱、盐的水溶液为什么能导电呢?
指出
这是因为它们在水溶液里解离出能自由移动的离子。
设疑
对于不同的电解质,它们在水溶液中解离的情况及导电的能力是否相同呢?
演示实验
将浓度均是0.5 mol/L等体积的盐酸、醋酸、氯化钠、纯水及氨水五种溶液,按由左至右的顺序,分别倒入烧杯后,连接好线路,接通电源。注意观察每个灯泡发光的明亮程度。
现象
连接插入在盐酸溶液和氯化钠溶液里的电极上的灯泡比较亮,连接在醋酸和氨水溶液的灯泡亮度较低,连接纯水的灯泡不亮。
说明
盐酸和氯化钠的水溶液导电性比醋酸溶液和氨水强。溶液导电性的强弱和溶液中能自由移动离子浓度的大小有关,溶液中的离子浓度大,溶液的导电性就强;反之,溶液的导电性就弱。因此,对于相同体积、相同浓度的电解质溶液,导电性强的,溶液中能自由移动的离子浓度就大;导电性弱的,溶液中能自由移动的离子浓度就小。由此可知,不同的电解质在溶液里的解离程度是不同的。
结论
不同的电解质在溶液里的解离程度是不同的。
讲解
不同的电解质在溶液里解离程度的不同是由其自身的结构所决定的。
在盐酸中,氯化氢分子在水分子的作用下,能够全部解离成能自由移动的氢离子和氯离子。
在氯化钠溶液里,钠离子和氯离子在水分子作用下,全部解离成能自由移动的氯离子和钠离子。上述解离过程中,可用解离方程式表示如下:
![]()
HCl H++Cl-
![]()
NaCl Na++Cl-
离子化合物(如NaCl、NaOH等)和含有强极性共价键的共价化合物在水溶液里能全部解离成为阴离子和阳离子,溶液中没有分子存在。这种在水溶液中能够全部解离成离子的电解质,叫做强电解质,如强酸、强碱和大部分盐类都属于强电解质。
板书
2.强电解质:水溶液中能够全部解离成离子的电解质:
![]()
HCl H++Cl-
![]()
NaCl Na++Cl-
讲解
像CH3COOH和NH3·H2O一类共价化合物溶解于水时,虽然也一样受水分子的作用,却只有一部分分子解离成离子,还有未解离的分子存在。它们的解离方程式为:
![]()
CH3COOH H++CH3COO-
+
![]()
NH3·H2O NH4 +OH-
这种在水溶液中只有部分解离成离子的电解质,叫做弱电解质,如弱酸、弱碱和水都是弱电解质。
板书
3.弱电解质:在水溶液中只有部分解离成离子的电解质。
![]()
CH3COOH H++CH3COO-
+
![]()
NH3·H2O NH4 +OH-
让学生思考
电解质与非电解质在结构上有什么本质区别?
板书
二、弱电解质的解离平衡
讲解
弱电解质在水溶液中不能全部解离成离子,溶液中还有未解离的分子存在,这是由弱电解质的结构所决定的。
弱电解质在水溶液里受水分子的作用解离成离子,这些离子在溶液中经互相碰撞和互相吸引,一部分离子又重新结合成弱电解质分子。这种解离过程是可逆过程,在一定条件(如温度、浓度)下,当弱电解质分子在水溶液里解离成离子的速率与离子重新结合成弱电解质分子的速率相等时,这时溶液里的离子浓度和分子浓度都保持不变,形成动态平衡,称为解离平衡。
板书
1.概念:一定条件下,当弱电解质分子在水溶液里解离成离子的速率与离子重新结合成弱电解质分子的速率相等时,这时溶液里的离子浓度和分子浓度都保持不变,形成动态平衡,称为解离平衡。
举例说明
在CH3COOH溶液里,只有一部分CH3COOH分子发生解离,这时在溶液里既有解离出的CH3COO-和H+ ,又有CH3COOH分子存在,在离子和分子之间存在着解离平衡。NH3·H2O溶液与此类似。
指出
根据平衡移动原理可知,解离平衡也是一种平衡体系,同样也服从化学平衡移动原理。
影响解离平衡的因素有多种,而温度和浓度对解离平衡的影响是最重要的。
多数电解质分子在水溶液里解离时,需要吸收热量,升高温度,一般有利于解离,使解离平衡向解离的方向移动。
板书
2.影响因素
(1)温度:升高温度,一般有利于解离。
讲解
增大电解质分子的浓度或减少相应离子的浓度,都会有利于弱电解质分子在溶液中的解离;减少电解质分子的浓度或增大相应离子的浓度,都会有利于离子结合成弱电解质分子。
板书
(2)浓度:增大电解质分子的浓度或减少相应离子的浓度,有利于解离。
课堂练习
在下列物质中哪些能够导电?为什么?写出解离方程式。哪些不能导电?为什么?
(1)NaOH的水溶液 (2)KCl晶体
(3)HAc的水溶液 (4)液氯
过渡
在农业生产中,农作物一般适宜在pH等于7或接近7的土壤里生长,在pH小于4的酸性土壤或在pH大于8的碱性土壤里,农作物一般都难于生长。鱼类能够安全生活的pH范围大致是6~9,pH超出一定范围,会直接造成鱼的死亡。那么,什么是溶液的pH?如何测定pH?pH在农业生产中有何作用?我们来学习水的离子积和溶液的pH的有关知识。
板书
第二节 水的离子积和溶液的pH
一、水的解离和水的离子积
讲解
由于纯水的导电能力极其微弱,不足以使白炽灯泡发光;但如果用精密的电流计测定,发现电流计的指针发生偏转,这就说明纯水具有微弱的导电能力。这一事实也证实了水是一种极弱的电解质,有解离平衡存在。
板书
![]()
H2O H++OH-
讲解
实验测得,在25 ℃时,每升水中只有10-7 mol的水分子解离。1个水分子解离产生1个H+和1个OH-,所以,纯水中 H+和OH-的物质的量浓度为:
[H+]=[OH-]=10-7 mol/L
指出
由于水的解离程度极小,1 L水为55.6 mol(1000 g÷18 g/mol=55.6 mol),其中仅有10-7 mol的水分子解离,相对55.6 mol的水来说,已解离部分可以忽略不计。由于解离前后水分子的物质的量几乎不变,可以看作是一个定值,则[H+]与[OH-]的乘积也是一个常数,常用Kw表示,通常把Kw叫做水的离子积常数,简称水的离子积。
板书
1.水的离子积:[H+]与[OH-]的乘积。
指出
Kw数值随温度的升高而增加。
投影
不同温度下的Kw
温度/℃ | Kw |
25 | 1.00×10-14 |
30 | 1.48×10-14 |
50 | 5.50×10-14 |
80 | 25.1×10-14 |
100 | 55.0×10-14 |
 
指出
在常温时,Kw值通常可认为是1×10-14。
板书
2.常温下,Kw=[H+][OH-]=1.0×10-1。
强调
利用Kw,可以计算酸或碱稀溶液中H+、OH-的浓度。
投影
求0.1 mol/L盐酸溶液中的[OH-]。
解:盐酸是强电解质,在溶液中完全解离,所以[H+]=0.1 mol/L,又因为[H+][OH-]=1.0×10-14,[OH-]=1.0×10-13mol/L。
答:略。
说明
在常温时,由于水的解离平衡的存在,不仅是纯水,就是在酸性或碱性的稀溶液里,[H+]和[OH-]的乘积也总是一个常数,即1×10-14。在酸性溶液里不是没有OH-,而是其中的[H+]比[OH-]大,同样在碱性溶液里的[OH-]比[H+]大。[H+]越大,溶液的酸性越强,[H+]越小,溶液的酸性越弱,在中性溶液里[H+]等于[OH-]。可见,任何一种水溶液,无论是中性、酸性、碱性,都含有H+和OH-,只是[H+]和[OH-]不同而已。
过渡
在实际生产中,经常要用到[H+]很小的溶液,表示溶液的酸碱性很不方便。为此,化学上常采用[H+]的负对数来表示溶液酸碱性的强弱,这种表示方法叫做溶液的pH。
板书
二、溶液的pH
1.概念:[H+]的负对数叫做溶液的pH。
pH=―lg[H+]
指出
pH常用于表示稀溶液酸碱性的强弱。
举例说明
纯水的[H+]=1×10-7 mol/L,其pH=―lg(1×10-7)=7;对于[H+]=1×10-3 mol/L的酸性溶液,则该溶液的pH=―lg(1×10-3)=3;对于[H+]=1×10-10 mol/L([OH-]=1×10-4 mol/L)的碱性溶液,则该溶液的pH=―lg(1×10-10)=10。
投影
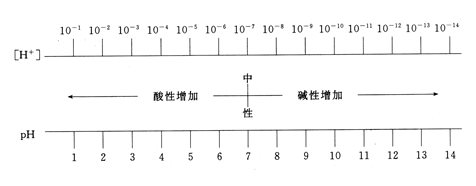
[H+]和pH与溶液酸碱性之间的关系
 
 
 
 
 
结论
溶液的酸性越强,pH越小;溶液的碱性越强,pH越大。溶液的pH相差1个单位,[H+]就相差10倍。
板书
酸性溶液,pH<7,pH越小,溶液酸性越强。
中性溶液,pH=7。
碱性溶液,pH>7,pH越大,溶液碱性越强。
过渡
pH常用于表示稀溶液酸碱性的强弱,测定溶液pH的方法有哪些呢?常见的方法有酸碱指示剂和pH试纸。
板书
2.测定溶液pH的方法
(1)酸碱指示剂。
讲解
某些有机弱酸或弱碱在不同pH的溶液里,能显示出不同颜色,通常用来指示溶液的酸碱性,称为酸碱指示剂。
投影
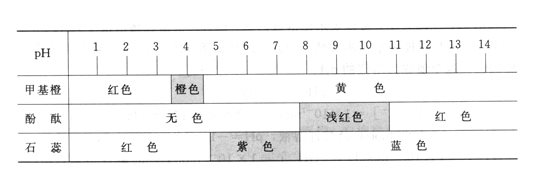
常见的酸碱指示剂及其变色范围
 
 
 
 
 
板书
(2)pH试纸。
讲解
由多种酸碱指示剂的混合溶液浸制而成的试纸,称pH试纸。
pH试纸在不同pH条件下,显示出不同的颜色,与标准比色卡相对照,就可得出被测溶液的近似pH。
投影
H试纸比色卡示意图

投影
课堂练习
1.在纯水中加入少量的酸或碱,水的离子积有无变化?
2.计算下列溶液的pH:
(1)0.1 mol/L NaOH溶液 (2)0.000 1 mol/L HCl溶液
3.酸性水溶液里有没有OH-?碱性水溶液里有没有H+?为什么?
小结
1.电解质的概念和强、弱电解质的解离特点。
2.弱电解质的解离平衡的概念和影响因素。
3.水的离子积的概念。
4.pH的概念和测定溶液pH的方法。
作业
综合练习:二、3;三。
 
【板书设计】
第二章 溶液
第一节 解离平衡
一、强电解质和弱电解质
1.电解质:在水溶液中或熔融状态下能导电的化合物。
2.强电解质:水溶液中能够全部解离成离子的电解质。
![]()
HCl H++Cl-
![]()
NaCl Na++Cl-
3.弱电解质:在水溶液中只有部分解离成离子的电解质。
![]()
CH3COOH H++CH3COO-
+
![]()
NH3·H2O NH4+OH-
二、弱电解质的解离平衡
1.概念:一定条件下,当弱电解质分子在水溶液里解离成离子的速率与离子重新结合成弱电解质分子的速率相等时,这时溶液里离子浓度和分子浓度都保持不变,形成动态平衡,称为解离平衡。
2.影响因素
(1)温度:升高温度,一般有利于解离。
(2)浓度:增大电解质分子的浓度或减少相应离子的浓度,有利于解离。
 
【板书设计】
第二节 水的离子积和溶液的pH
一、水的解离和水的离子积
![]()
H2O H++OH-
1.水的离子积:[H+]与[OH-]的乘积。
2.常温下,Kw=[H+][OH-]=1.0×10-1。
二、溶液的pH
1.概念:[H+]的负对数叫做溶液的pH。
pH =-lg[H+]。
酸性溶液,pH<7,pH越小,溶液酸性越强。
中性溶液,pH=7。
碱性溶液,pH>7,pH越大,溶液碱性越强。
2.测定溶液pH的方法。
(1)酸碱指示剂。
(2)pH试纸。
 
 
53
 

 负责人:黄剑鹏
负责人:黄剑鹏